神經(jīng)干細(xì)胞-祖細(xì)胞 (NSPC) 是多能、自我更新的細(xì)胞,可產(chǎn)生放射狀膠質(zhì)細(xì)胞 (RGC)。RGC 隨后在神經(jīng)發(fā)育過程中產(chǎn)生神經(jīng)元和膠質(zhì)細(xì)胞。在這里,我們描述了 NSPC 分離和培養(yǎng)以形成稱為神經(jīng)球的克隆聚集體的過程。本章概述了多種檢測方法,使我們能夠量化這些細(xì)胞的增殖、自我更新潛力和分化的差異[1]。
神經(jīng)干細(xì)胞培養(yǎng)權(quán)威指南:NSPC高效提取與分化技術(shù)解析
1簡介
在干細(xì)胞和祖細(xì)胞研究領(lǐng)域,了解控制神經(jīng)生物學(xué)的復(fù)雜過程對于理解大腦內(nèi)的功能通路至關(guān)重要。干細(xì)胞和祖細(xì)胞具有分化成神經(jīng)系統(tǒng)內(nèi)各種細(xì)胞類型的非凡能力,這使得它們對于研究神經(jīng)發(fā)育和神經(jīng)退行性疾病或創(chuàng)傷相關(guān)損傷的潛在治療應(yīng)用具有無價的價值。然而,理解控制其行為的潛在機(jī)制需要可靠且多功能的實(shí)驗(yàn)技術(shù)。
近年來,神經(jīng)球測定法就是一項(xiàng)獲得廣泛認(rèn)可的技術(shù)。該測定法最初 1992年開發(fā),現(xiàn)已成為神經(jīng)干細(xì)胞研究的基石。該測定法能夠從中樞神經(jīng)系統(tǒng)的不同區(qū)域(包括胚胎、胎兒和成人階段)分離、擴(kuò)增和表征神經(jīng)干細(xì)胞。此外,該測定法還能檢查干細(xì)胞和祖細(xì)胞對各種基因和藥理操作的反應(yīng),為神經(jīng)發(fā)育過程、神經(jīng)再生和疾病建模提供有價值的見解。這些神經(jīng)球由一群異質(zhì)性細(xì)胞組成,其中包括神經(jīng)干細(xì)胞和祖細(xì)胞,它們能夠分化成中樞神經(jīng)系統(tǒng)的主要細(xì)胞類型,包括神經(jīng)元、星形膠質(zhì)細(xì)胞和少突膠質(zhì)細(xì)胞。通過利用特定的生長因子和培養(yǎng)條件,研究人員可以有效地維持干細(xì)胞和祖細(xì)胞的自我更新能力,促進(jìn)其增殖并防止自發(fā)分化。
這項(xiàng)檢測為研究干細(xì)胞和祖細(xì)胞神經(jīng)生物學(xué)提供了許多優(yōu)勢。
首先,神經(jīng)球檢測可以大量擴(kuò)增神經(jīng)干細(xì)胞和祖細(xì)胞,同時保留其多能性。
其次,神經(jīng)球檢測提供了一種三維 (3D) 培養(yǎng)系統(tǒng),更接近于體內(nèi)微環(huán)境。神經(jīng)球的3D特性為干細(xì)胞和祖細(xì)胞提供了支持性的“體外環(huán)境”,模擬了神經(jīng)系統(tǒng)中的細(xì)胞相互作用和空間組織。
第三,神經(jīng)球檢測可以檢查干細(xì)胞和祖細(xì)胞對各種因素和刺激的反應(yīng)。通過調(diào)節(jié)培養(yǎng)基的成分,研究人員可以研究生長因子、小分子和其他生物線索對干細(xì)胞行為的影響。此外,該檢測法還允許引入基因操作,例如基因過表達(dá)、缺失或敲低,以剖析干細(xì)胞和祖細(xì)胞神經(jīng)生物學(xué)中涉及的分子通路。神經(jīng)球檢測法還提供了藥物篩選和毒性測試的機(jī)會,有助于開發(fā)新的治療策略。
最后,這些 NSPC 的分化能力也可以在體外建模,從而確定提取的細(xì)胞中特定的祖細(xì)胞群是否可能受到損害。
總之,神經(jīng)球試驗(yàn)已成為了解干細(xì)胞和祖細(xì)胞神經(jīng)生物學(xué)的寶貴工具。它能夠擴(kuò)增和維持多能細(xì)胞,具有3D培養(yǎng)環(huán)境,并且能夠靈活地研究各種因素和疾病,使其成為揭示控制神經(jīng)發(fā)育、再生和疾病進(jìn)展的復(fù)雜機(jī)制的理想系統(tǒng)。
2材料
2.1 NSPC 分離和培養(yǎng)
- 1.磷酸鹽緩沖液 (PBS):配置10×溶液,將80gNaCl、2 g KCl、14.4 g Na?2?HPO?4加至 800 mL 蒸餾水。調(diào)節(jié) pH 至 7.4 并加至 1 L。對于 1× PBS,將 100 mL 10× PBS 加至 900 mL 蒸餾水。
- 2.漢克斯平衡鹽溶液(HBSS)。
- 3.神經(jīng)球基礎(chǔ)培養(yǎng)基(NSBM;1:1 杜氏改良伊格爾培養(yǎng)基 [DMEM] 和 F12、4 μg/mL 肝素、100 μg/mL 青霉素/鏈霉素)。
- 4.堿性成纖維細(xì)胞生長因子 (bFGF)。
- 5.表皮生長因子(EGF)。
- 6.B27(不含維生素A)。
- 7.低粘附性 6 孔組織培養(yǎng)板。
- 8.神經(jīng)球解離溶液(50 mL HBSS、0.01 g EDTA、0.0125 g 胰蛋白酶 [0.25 mg/mL]、0.119 g N-2-羥乙基哌嗪-N’-2-乙磺酸 [HEPES],pH 值 8;以 1 mL 分裝在 ?20 °C 下冷凍,使用前立即解凍)。
- 9.中和溶液(50 mL HEPES 緩沖 DMEM、0.007 g 大豆胰蛋白酶抑制劑 [0.14 mg/mL],以 1 mL 分裝在 ?20 °C 下冷凍,使用前立即解凍)。
- 10.60 孔 Terasaki 細(xì)胞培養(yǎng)板。
- 11.二甲基亞砜(DMSO)。
2.2神經(jīng)球分化
- 1.8孔腔室載玻片。
- 2.聚-D-賴氨酸和層粘蛋白。
- 3.胎牛血清(FCS)。
- 4.4% 多聚甲醛 (PFA):將 4 克 PFA 與約 70 毫升去離子無菌水混合。在 60 °C 下?lián)u動溶解。溶解后,過濾 PFA,并用無菌去離子水加滿至最終體積 100 毫升。
- 5.用于識別神經(jīng)元 (小鼠抗 Tuj1) 和星形膠質(zhì)細(xì)胞 (兔抗 GFAP) 的一抗。
- 6.二抗山羊抗鼠 555 和山羊抗兔 488。
- 7.4′,6-二脒基-2-苯基吲哚 (DAPI)。
- 8.水性封固劑。
2.3逆轉(zhuǎn)錄病毒轉(zhuǎn)導(dǎo)
- 1.0.5 M氯化鈣。
- 2.穩(wěn)定轉(zhuǎn)導(dǎo)逆轉(zhuǎn)錄病毒gag和pol基因的人類胚胎腎 (HEK) 細(xì)胞 (HEK-293gp;病毒包裝細(xì)胞系)。
- 3.含有 5% FCS 和100μg/mL青霉素/鏈霉素的 DMEM(DMEM/FCS/PS)。
- 4.60cm2個組織培養(yǎng)板。
- 5.DMEM補(bǔ)充有5-10%FCS和100μg/mL 青霉素/鏈霉素。
- 6.2× HEPES 緩沖鹽水,pH 值 7.0 (HeBS)。
- 7.包含目的蛋白質(zhì)的逆轉(zhuǎn)錄病毒載體(例如MSCV)。
- 8.水泡性口炎病毒糖蛋白(VSVG)包膜質(zhì)粒。
- 9.5 mL 注射器和0.45μm注射器過濾器。
- 10.超速離心機(jī)和10mL超速離心管。
- 11.水中重組纖連蛋白 (rFN)濃度為1mg/mL。
- 12.補(bǔ)充有2%牛血清白蛋白 (BSA) 的PBS。
- 13.24孔組織培養(yǎng)板。
3方法
3.1胚胎NSPC分離
- 1.在E14.5時對懷孕的母鼠實(shí)施安樂死,從子宮中收集胚胎,并立即放入含有冷 PBS 的培養(yǎng)皿中。
- 2.一次一個地去除胚胎的絨毛膜并除去胎盤(見注釋1)。
- 3.解剖胚胎的頭部,并在解剖顯微鏡下輕輕地將頭骨從大腦中切掉。
- 4.接下來,沿矢狀切開大腦,將其分成左、右半球。
- 5.去除每個半球的外部皮質(zhì),留下內(nèi)側(cè)、尾部和外側(cè)神經(jīng)節(jié)隆起(見注釋2)。
- 6.一旦解剖,將神經(jīng)節(jié)隆起放入含有5mL新鮮HBSS的15mLFalcon管中,放在冰上,直到所有大腦都被解剖(圖1)。
- 7.在層流罩中,用移液器輕輕研磨以分解組織。
- 8.將分解的組織以1200×g的速度離心5分鐘。
- 9.去除上清液并將細(xì)胞重新懸浮在5mL NSBM中,補(bǔ)充10ng/mL堿性成纖維細(xì)胞生長因子、20ng/mL 表皮生長因子和 1:50 B27(不含維生素 A)。
- 10.將細(xì)胞轉(zhuǎn)移到低粘附性6孔板中,使細(xì)胞形成克隆聚集體(神經(jīng)球)。
- 11.在37 °C和5%CO2條件下孵育細(xì)胞。
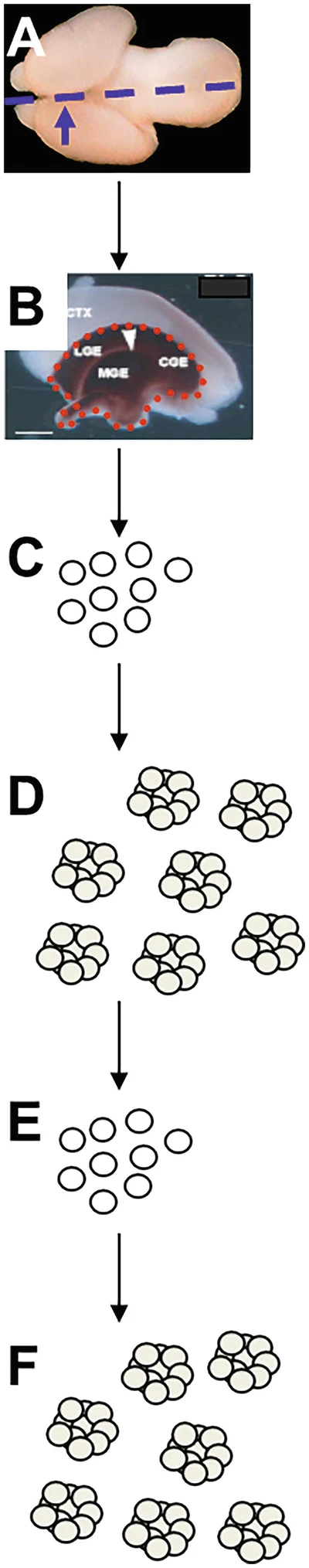
胚胎采集后,將腦從顱骨中取出 (?a?)。接下來,去除皮質(zhì)層,只留下外側(cè)、內(nèi)側(cè)和尾部神經(jīng)節(jié)隆起(分別為 LGE、MGE 和 CGE;b)。然后用移液器輕輕打碎,留下單細(xì)胞懸浮液 (?c?)。培養(yǎng)后,GE 中的神經(jīng)干細(xì)胞/祖細(xì)胞 (NSPC) 形成克隆聚集體,稱為神經(jīng)球 (?d?)。這些可以分離(“傳代”)成進(jìn)一步的單細(xì)胞懸浮液 (?e?) 并重新接種,在那里它們將再次重新形成神經(jīng)球 (?f?)
3.2 NSPC文化
- 1.每2天取出2.5mL(一半體積)培養(yǎng)基(注意避免丟棄神經(jīng)球;參見?注釋 3)。
- 2.加入2.5mL新鮮NSBM,其中含有1:50不含維生素A的B27以及兩倍濃度的 EGF 和 bFGF(20 ng/mL βFGF、40 ng mL EGF;稱為 NSBM+2×GFs)。這將確保 GFs 的最終濃度保持在 1×。
3.3神經(jīng)球解離和傳代
- 1.維持培養(yǎng)直至大多數(shù)神經(jīng)球變大,中心呈深色(約5-7天生長;圖2)。培養(yǎng)基將開始變成橙色/黃色。
- 2.為了傳代,將細(xì)胞轉(zhuǎn)移到15mL Falcon 管中,并以700×g離心7分鐘。
- 3.除去上清液并在室溫下將神經(jīng)球輕輕懸浮在 500 μL 解離溶液中3分鐘,并輕輕研磨。
- 4.在室溫下用500 μL中和溶液中和解離溶液3分鐘,并輕輕研磨。
- 5.接下來,通過添加 8 mL NSBM 來清洗分離的細(xì)胞,然后在1300×g下離心5分鐘?。
- 6.去除上清液并將細(xì)胞重新懸浮在 1 mL NSBM 中,進(jìn)行細(xì)胞計(jì)數(shù)。
- 7.取所需數(shù)量的細(xì)胞(取決于所進(jìn)行的分析;見下文)并加入5mLNSBM+1×GF。對于常規(guī)傳代,細(xì)胞應(yīng)以1–5 ×105個細(xì)胞/毫升的密度接種。
- 8.將新傳代的細(xì)胞放入6孔低粘附組織培養(yǎng)板的新鮮孔中,并在 37°C和5%CO2下孵育。
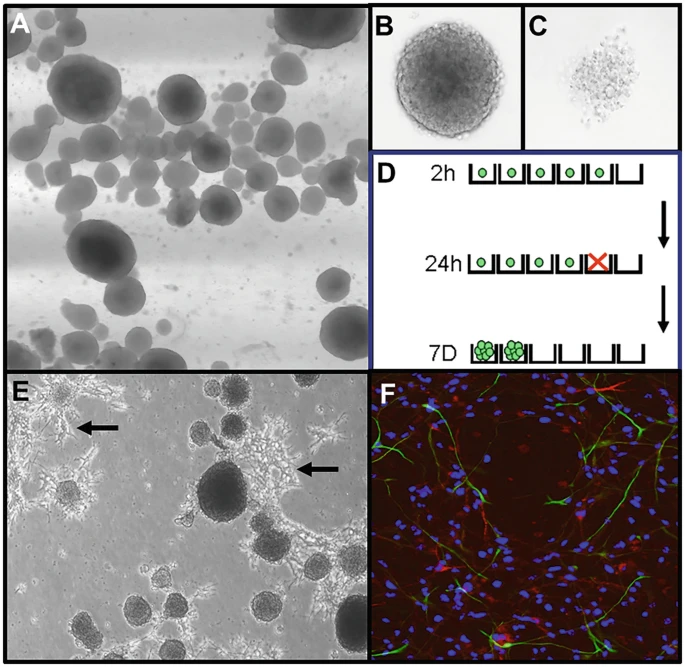
正常神經(jīng)球生長為自由漂浮的球體 (?a?);健康、活的神經(jīng)球?qū)⒊尸F(xiàn)為中心呈深色的實(shí)心球 (?b?),而大多數(shù)細(xì)胞已發(fā)生凋亡或壞死的神經(jīng)球?qū)⒊尸F(xiàn)松散和蒼白 (?c?)。可將健康神經(jīng)球分離并以 5 個細(xì)胞/10 μL 的密度接種于 Terasaki 板中(每板 60 個孔)。接種后(2 小時)立即存在的活細(xì)胞數(shù)量可進(jìn)行定量分析 — 大多數(shù)孔中將有 0 個或 1 個細(xì)胞(綠點(diǎn);d)。培養(yǎng) 24 小時后,很少細(xì)胞會開始分裂,但有些細(xì)胞將發(fā)生凋亡(紅色 x)。到 7 天時,任何具有自我更新潛力的細(xì)胞都將產(chǎn)生包含 >4 個細(xì)胞的神經(jīng)球,而無潛力的細(xì)胞將發(fā)生凋亡。當(dāng)在正常粘附板上生長時,神經(jīng)球會粘附、長出突起(箭頭),并開始分化(e)。然后可以使用免疫組織化學(xué)(f)檢測,以可視化 Tuj1+神經(jīng)元(紅色)和 GFAP?+星形膠質(zhì)細(xì)胞(綠色)占所有細(xì)胞的比例(藍(lán)色細(xì)胞核;DAPI)
3.4累積細(xì)胞數(shù)測定
- 1.按照3.2節(jié)步驟2的步驟分離神經(jīng)球后,計(jì)數(shù)細(xì)胞并以1-5×105細(xì)胞/mL的濃度接種于 NSBM + 1 × GF 的低粘附性6孔板上。
- 2.每 2-3 天,移除培養(yǎng)基并更換為新鮮的 NSBM + 2 × GF。這將確保細(xì)胞繼續(xù)在 NSBM + 1 × GF 中生長。
- 3.每7天,按照第3.2節(jié)步驟2進(jìn)行細(xì)胞傳代,并記錄每周計(jì)數(shù)。根據(jù)神經(jīng)球的健康狀況,應(yīng)重復(fù)此操作 5-6 周。
3.5神經(jīng)球存活率測定
- 1.在 NSBM +1 × GF 的低粘附性 6 孔板上,每孔接種約 20-50 個第 7 天神經(jīng)球。
- 2.計(jì)算存在的神經(jīng)球的確切數(shù)量。
- 3.將神經(jīng)球放置 14 天,不要更換培養(yǎng)基或重新添加生長因子。
- 4.計(jì)算由仍然存活的細(xì)胞組成的神經(jīng)球的確切數(shù)量(圖2)。
3.6克隆密度測定法測量不依賴于“體外微環(huán)境”的神經(jīng)球形成
- 1.按照3.2節(jié)步驟2分離神經(jīng)球,并對分離的細(xì)胞進(jìn)行細(xì)胞計(jì)數(shù)。
- 2.將 1-2 × 10?4 個細(xì)胞放入 NSBM + 1 × GF 的低粘附性6孔板中,每孔培養(yǎng)。
- 3.每 2 天,取出培養(yǎng)基并用新鮮的 NSBM + 2 × GF 替換。這將確保細(xì)胞繼續(xù)在 NSBM + 1 × GF 中生長。
- 4.第 7 天,計(jì)算已形成的神經(jīng)球的數(shù)量。
3.7單細(xì)胞分析確定神經(jīng)球形成潛力
- 1.按照3.2節(jié)步驟2分離神經(jīng)球,并對分離的細(xì)胞進(jìn)行細(xì)胞計(jì)數(shù)。
- 2.將細(xì)胞以 500 個細(xì)胞/mL 的濃度重懸于 NSMB + 1 × GF 中。
- 3.將 10 μL 細(xì)胞懸浮液分裝到 60 孔 Terasaki 板的每個孔中。
- 4.統(tǒng)計(jì) 2 小時后每個孔中的細(xì)胞數(shù)。每個孔中應(yīng)該有 0 或 1 個細(xì)胞;在極少數(shù)情況下,可能會看到 2 個細(xì)胞。
- 5.統(tǒng)計(jì) 24 小時和 48 小時時存在的細(xì)胞數(shù)量;一些 NSPC 可能已開始分裂。
- 6.在 48 小時時,向仍含有至少 1 個活細(xì)胞的孔中添加 10 μL NSBM + 2 × GF。
- 7.對已形成由≥4個細(xì)胞組成的神經(jīng)球的孔數(shù)進(jìn)行評分。
3.8分化試驗(yàn)定量神經(jīng)源性潛能
- 1.準(zhǔn)備8孔腔室載玻片,每個孔涂上150μL聚-D-賴氨酸 + 20 μg/mL 層粘連蛋白。這將確保 NSPC 能夠粘附。
- 2.在室溫下孵育 1 小時。
- 3.去除聚-D-賴氨酸+層粘連蛋白并用 PBS 清洗 2 × 5 分鐘。
- 4.按照3.2小節(jié)步驟2解離 7 天培養(yǎng)的神經(jīng)球,并對解離的細(xì)胞進(jìn)行細(xì)胞計(jì)數(shù)。
- 5.以700×g的速度離心細(xì)胞7 分鐘。
- 6.將細(xì)胞懸浮在補(bǔ)充有 1% 胎牛血清的500μL NSBM + 1 × GF 中。
- 7.將1×105個細(xì)胞/孔放入 8 孔板中。
- 8.每 2 天取出培養(yǎng)基并替換為新鮮的 NSBM + 1 × GF + 1% FCS。
- 9.7 天后,在室溫下用 PBS 中的 4% 多聚甲醛固定細(xì)胞 30 分鐘。
- 10.接下來,用 PBS 中的 0.1% Triton X-100 對細(xì)胞進(jìn)行通透 10 分鐘。
- 11.通過在 PBS 中的 3% 牛血清白蛋白 (BSA) 中孵育細(xì)胞 30 分鐘來進(jìn)行阻斷。
- 12.與鼠抗 Tuj1(在封閉溶液中稀釋至 1:1000)(每孔 100 μL)一起在 4 °C 下孵育過夜。
- 13.用 PBS 清洗載玻片 2 次,每次 2 分鐘,然后在室溫下與山羊抗鼠 555 二抗孵育 30 分鐘,在封閉溶液中稀釋至 1:1000(每孔 100 μL)。
- 14.用 PBS 清洗載玻片 2 × 3 分鐘,然后用 PBS 中的 4% 多聚甲醛在室溫下固定 10 分鐘。
- 15.用 PBS 清洗載玻片 2 × 3 分鐘,并與兔抗 GFAP(在封閉溶液中稀釋至 1:500;每孔 100 μL)在 4 °C 下孵育過夜。
- 16.用 PBS 清洗載玻片 2 次,每次 2 分鐘,然后與山羊抗兔 488 二抗(每孔 100 μL)一起在室溫下孵育 30 分鐘,在封閉溶液中稀釋至 1:1000。
- 17.先用 PBS 清洗載玻片 3 次,每次 2 分鐘,然后在室溫下用 PBS 稀釋的 DAPI 孵育 5 分鐘。
- 18.使用提供的腔室拆卸工具小心地取出介質(zhì)腔室,然后使用剃須刀片或美工刀刮掉膠水。
- 19.然后將載玻片安裝在水性封固劑中,并放置干燥過夜,然后進(jìn)行成像(圖2)。
3.9冷凍神經(jīng)球
- 1.培養(yǎng)神經(jīng)球直至其達(dá)到一定的尺寸和密度,表明它們已準(zhǔn)備好通過。
- 2.從培養(yǎng)容器(例如燒瓶、培養(yǎng)板)中取出神經(jīng)球,以 700 ×??g的速度離心7 分鐘。
- 3.除去上清液并將細(xì)胞輕輕地重新懸浮在 500 μL NSBM + 2 × GF 中,其中含有 B27 的濃度為 1:25 而不是 1:50。
- 4.將神經(jīng)球轉(zhuǎn)移到冷凍管中并置于冰上。將 500 μL 20% DMSO(溶于 DMEM)加入冷凍管中并輕輕混勻。
- 5.冷凍管應(yīng)立即放入冷凍保存容器中,以確保緩慢冷凍。冷凍后,應(yīng)將樣本放入液氮中保存。
3.10解凍神經(jīng)球
- 1.將 NSBM + 1 × GF(每個樣品 5 毫升)預(yù)熱至 37 °C。
- 2.從液氮儲存中取出冷凍管并置于 37°C 下快速解凍。
- 3.立即將解凍的神經(jīng)球轉(zhuǎn)移到預(yù)熱的培養(yǎng)基中,并以 700 ×g的速度離心7 分鐘。
- 4.除去上清液并將神經(jīng)球輕輕懸浮在 5 mL 新鮮 NSBM + 1 × GF 中。
3.11逆轉(zhuǎn)錄病毒轉(zhuǎn)導(dǎo)
- 1.將HEK-293gp細(xì)胞放入60cm?2培養(yǎng)板中的DMEM/FCS/PS中,培養(yǎng)直至匯合率達(dá)到約90%。
- 2.將 500 μL 2 × HEPES 緩沖鹽水(pH 7.0)(HeBS)加入到 10 mL 聚丙烯管中。
- 3.將 10 μg 質(zhì)粒/板與 10 μg/板水泡性口炎病毒糖蛋白 (VSVG) 包膜質(zhì)粒和 0.5 M CaCl?2相結(jié)合,最終體積為 250 μL,用無菌 H?2?O溶解。
- 4.將質(zhì)粒/VSVG 混合物逐滴添加到 HeBS 中,同時使空氣通過 HeBS 起泡(例如,使用移液器或類似設(shè)備)。
- 5.將反應(yīng)混合物在室溫下孵育 20 分鐘。
- 6.逐滴加入HEK-293gp細(xì)胞中并在37°C、5%CO 2下孵育24小時。
- 7.取出培養(yǎng)基并替換為 10 mL NSBM。
- 8.將細(xì)胞在 37 °C、5% CO 2條件下孵育 72 小時。
- 9.從孔中取出細(xì)胞并以 1400 ×g的速度離心5 分鐘。
- 10.通過 0.45 μm 注射器過濾器過濾上清液以去除細(xì)胞碎片。
- 11.將上清液放入超速離心機(jī),以 25,000×g的速度離心 90 分鐘,以濃縮逆轉(zhuǎn)錄病毒。
- 12.取出 9.5 mL 上清液,輕輕將逆轉(zhuǎn)錄病毒顆粒懸浮于 1 mL 新鮮 NSBM 中。病毒可以 500 μL 等分試樣形式儲存于 ?70 °C。
- 13.將 19 μg rFN 涂在 200 μL PBS 中的 24 孔組織培養(yǎng)板中的單個孔中,在 4 °C 下至少放置 16 小時。
- 14.在室溫下用 400 μL PBS + 2% BSA 清洗每個孔 30 分鐘。
- 15.在室溫下用 2 mL PBS 清洗 2 次。
- 16.向每個孔中添加 500 μL 逆轉(zhuǎn)錄病毒上清液,并在 32°C 下以 1500× g的速度離心?60 分鐘,以促進(jìn)逆轉(zhuǎn)錄病毒顆粒與 rFN 結(jié)合。
- 17.按照3.2小節(jié)步驟2解離神經(jīng)球,去除病毒上清液,并將 5×105個NSPC(含 NSBM + 1 × GF)接種到每個孔中(見?注釋 4)。
- 18.培養(yǎng)24h,除去NSBM,加入500μL神經(jīng)球中和液。
- 19.孵育 3 分鐘,用移液器輕輕研磨細(xì)胞,并轉(zhuǎn)移到 15 mL 管中。
- 20.以1300 ×g的速度離心5 分鐘。
- 21.除去上清液,將細(xì)胞懸浮在 2 mL NSBM + 1 × GF 中,并轉(zhuǎn)移至超低附著6孔板(見注釋5)。
- 22.按照小標(biāo)題3.2所述培養(yǎng)神經(jīng)球。
- 23.如果逆轉(zhuǎn)錄病毒含有熒光標(biāo)記,則使用熒光顯微鏡觀察成功感染的神經(jīng)球(圖3)。
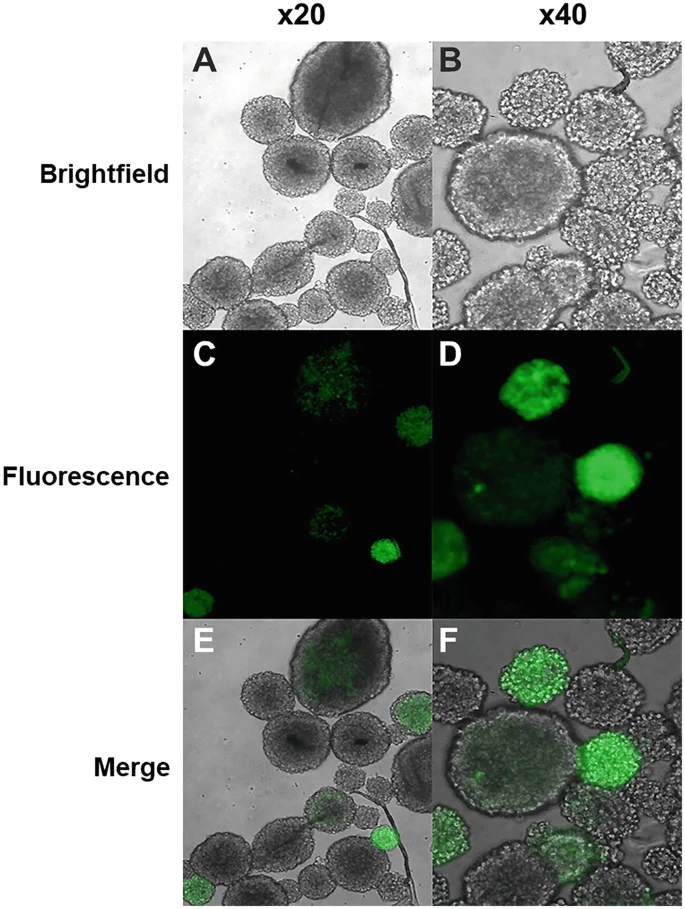
神經(jīng)球(此處顯示為 20 倍和 40 倍)生長 7 天,分解,生長為單層,感染逆轉(zhuǎn)錄病毒,并重新形成神經(jīng)球。在明場光學(xué)系統(tǒng)(a、b)和藍(lán)光(c、d)下檢查這些神經(jīng)球,以識別 GFP+ 神經(jīng)球。還顯示了合并的照片(e、f)
4注
1.將每個胚胎放在單獨(dú)的培養(yǎng)皿中解剖。如果需要對胚胎進(jìn)行基因分型,則取出一小塊肢體組織、剩余的大腦或卵黃囊,以便隨后提取 DNA 并進(jìn)行基因分型。
2.神經(jīng)節(jié)隆起 (GE) 很容易被識別,因?yàn)樗鼈冊诿饕曇帮@微鏡下看起來比上面的皮質(zhì)層更暗。
3.為了避免在更換一半培養(yǎng)基時丟失神經(jīng)球,請輕輕旋轉(zhuǎn)培養(yǎng)板以收集每個孔中心的神經(jīng)球(特別是對于>7 天的神經(jīng)球)。然后可以從邊緣去除培養(yǎng)基,以確保神經(jīng)球損失最小。
4.將神經(jīng)球接種到這些培養(yǎng)皿中,可使神經(jīng)干細(xì)胞以單層培養(yǎng)物(而不是漂浮的神經(jīng)球)的形式生長,而不會誘導(dǎo)分化。單層培養(yǎng)將大大提高該技術(shù)中逆轉(zhuǎn)錄病毒的感染效率。
5.使用含有熒光報告基因的質(zhì)粒非常有益,因?yàn)榭梢允褂脽晒饧せ罴?xì)胞分選 (FACS) 分析確定陽性細(xì)胞和感染效率。
參考資料:Gasperoni, J., Dworkin, S. (2024). Neural Stem/Progenitor Cell (NSPC) Extraction and Culture. In: Dworkin, S. (eds) Neurobiology. Methods in Molecular Biology, vol 2746. Humana, New York, NY. https://doi.org/10.1007/978-1-0716-3585-8_9
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信