當“干細胞治療”為慢性腎病患者帶來新希望時,一個現實的選擇題也隨之而來:是應該在國內尋求治療,還是遠赴海外?
網絡上信息繁雜,國內一些機構宣傳“技術領先”,而海外醫療又常被貼上“先進可靠”的標簽。這令許多患者和家庭感到迷茫:國內外治療究竟有何不同?哪里更適合我?
為了更理性地看待這個問題,本文將立足當前全球干細胞治療慢性腎病的真實研發格局,從技術路徑、監管環境、臨床可及性及個人成本效益等多個維度,系統對比國內外的現狀與特點,幫助您看清不同選擇背后的“潛在優勢”與“現實挑戰”,從而做出更清醒、更符合自身情況的判斷。

一、為什么要把國內和國外放在一起比較?
慢性腎病是一種慢性進展性疾病,隨著病情加重,患者可能面臨透析或腎移植。干細胞治療作為一種新興的再生醫學手段,因其潛在的腎組織修復能力而被患者寄予厚望。
然而,干細胞治療尚處于發展階段,其安全性、療效及長期效果仍在研究中。國內和國外的醫療環境、技術水平及監管體系存在差異,這使得患者在選擇時必須綜合考量,而不僅僅依賴廣告或輿論宣傳。比較國內外的現狀,有助于了解各自的優勢與局限,從而做出理性決策。
二、干細胞治療慢性腎病全球批準現狀一覽
需要首先明確的是:截至目前(2025年底),全球范圍內尚無任何干細胞治療慢性腎病的產品獲得全面、無條件的正式上市批準,成為標準臨床治療。
因此,對任何宣稱“國內外已經批準干細胞治療慢性腎病”的診所或機構,都應保持高度警惕,這類說法往往缺乏監管依據,甚至存在誤導或欺詐風險。
不過,這并不意味著該領域停滯不前。實際上,全球已有多項干細胞療法針對慢性腎病進行高強度臨床研究,并取得了值得關注的進展,這些研究正穩步推進,走在未來可能獲批的道路上。
三、國內干細胞治療慢性腎病現狀
中國在干細胞治療慢性腎病的研究并非單一路線,而是在特定領域取得了令人矚目的突破。
其中,腎前體細胞療法通過利用患者自身的腎前體細胞修復腎單位,展示了“直接再生”的潛力。2025年5月我國細胞公司自研的細胞藥物REGEND003已進入I期臨床試驗,這也是全球首個從尿液無創提取腎前體細胞的嘗試,代表了國內在源頭創新方面的國際領先水平,療效仍需進一步驗證。[1]
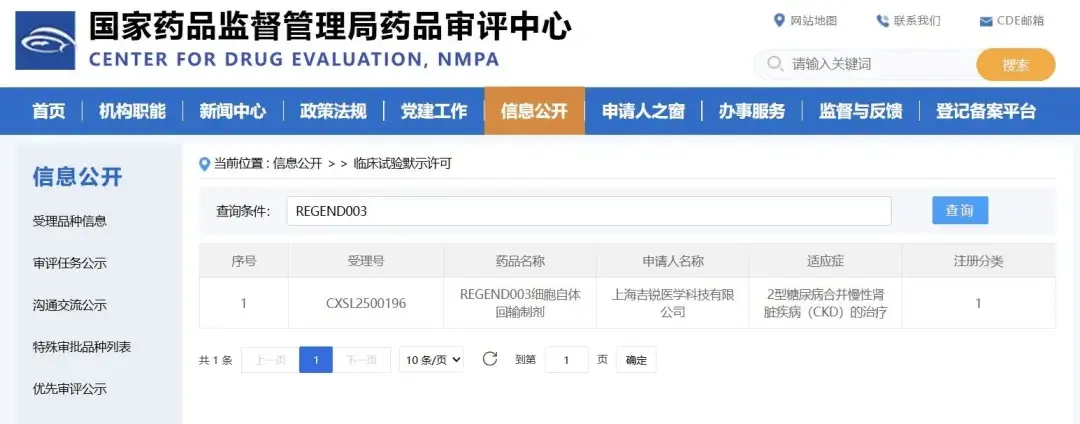
與此同時,間充質干細胞療法則著眼于改善腎臟微環境,通過分泌抗炎和抗纖維化因子,保護腎功能。這間充質干細胞(MSC)療法通過改善腎臟微環境,分泌抗炎和抗纖維化因子,從而保護腎功能。它是慢性腎病研究中最廣泛探索的方向,多項臨床試驗正在進行,為未來臨床應用積累了數據基礎。
例如,2025年11月在Kidney Week 2025上,華中科技大學同濟醫院報告了19例CKD 3–4期患者接受人臍帶間充質干細胞(UC-MSC)靜脈輸注的結果:[2]
- 腎小球濾過率(eGFR):UC-MSC組在6個月和12個月時均上升(+1.5、+6.8 mL/min/1.73m2),對照組變化不明顯(?0.4、+2.4)。
- 蛋白尿:UC-MSC組保持穩定,對照組隨時間增加,第9個月差異顯著(P≈0.04)。
- 胱抑素C:UC-MSC組6、9個月均優于對照組(P≈0.011、0.03)。
- 免疫指標:UC-MSC組NK細胞活性保持穩定,對照組下降明顯。
這些數據與干細胞的生物學特性高度一致——抗炎、抗纖維化與免疫調節。
研究團隊認為,干細胞在一定程度上“放慢”了腎功能惡化的速度,讓腎臟獲得了更多修復的時間。

此外,國內學者還在探索干細胞聯合中藥的聯合治療策略,認為中藥能夠調控信號通路、增強干細胞功能,對腎纖維化這一CKD進展關鍵病理具有潛在輔助療效。
總體來看,中國在干細胞治療慢性腎病的技術研發上,不僅有創新突破,也在穩步推進多條可行技術路線,為未來臨床應用打下了堅實基礎。
四、國外干細胞治療慢性腎病現狀
國際上干細胞治療慢性腎病的研發高度集中在兩條技術路徑上,并已進入中后期人體試驗。
1.美國自體腎臟細胞療法
該療法由美國ProKidney公司研發,是目前全球進展最快的干細胞類腎病療法之一,已進入三期臨床試驗。
核心治療邏輯:該療法從患者腎臟中取出一小片組織(活檢),分離出有修復潛力的自體細胞,在實驗室擴增后,重新注射回患者雙側腎臟。其目標不是暫時替代功能,而是直接修復和再生受損的腎單位。
2025年11月,該公司公布的一項二期臨床試驗完整結果,為其提供了重要支持。[3]
- 核心療效:在晚期糖尿病腎病患者中,接受標準雙劑量注射的患者,其腎功能下降速度(以eGFR斜率衡量)改善了78%,具有顯著的統計學和臨床意義。
- 劑量重要性:數據明確顯示療效與治療方案相關。接受標準雙劑量注射的患者,效果明顯優于僅接受單次或按需注射的探索方案組。
- 安全性:療法耐受性良好,未出現不可接受的安全風險。

基于上述積極數據,該療法已啟動大規模國際多中心三期注冊試驗。美國FDA已同意將eGFR斜率作為試驗評估的關鍵指標,這為未來加速審批奠定了基礎。
預計支持上市申請的關鍵數據將于2027年第二季度公布。公布支持加速審批申請的主要數據。Rilparencel 是目前唯一正在進行3期臨床試驗的用于治療CKD合并2型糖尿病的細胞療法。
2.日本誘導多能干細胞療法
日本京都大學iPS細胞研究所(CiRA)的研究團隊正在探索利用誘導多能干細胞(iPSC)生成腎臟前體細胞,用于慢性腎臟病(CKD)的再生性治療。這一策略屬于“通用型”細胞療法,理論上能解決細胞來源受限的問題,因為iPSC可從患者自身或臨床級細胞庫中來源,并在體外大規模增殖。
2025年6月,在最新的研究中,科研團隊成功開發了能夠從人類iPSC高效擴增腎單位前體細胞的方法,并將這些細胞移植到慢性腎病模型小鼠體內。移植后,研究者觀察到腎功能指標(如血尿素氮和肌酐)惡化被抑制,同時腎間質纖維化的進程顯著減少,表明移植細胞可在體內發揮延緩腎功能下降的效果。

研究認為,這些細胞分泌的再生因子(如血管內皮生長因子 VEGF?A)可能促進局部新血管生成,從而緩解腎損傷。
目前,該團隊正根據這些動物實驗的數據優化細胞制備工藝和安全性評估,計劃在未來幾年內啟動首次針對CKD患者的人體臨床試驗。這樣的人體研究目標是驗證iPSC衍生腎臟前體細胞在安全性和有效性方面的表現,為將來再生療法的臨床轉化奠定基礎。
除了上述兩項臨床進展外,仍有多項干細胞療法在早期臨床和動物實驗中顯示出積極信號,但多數處于臨床Ⅰ期Ⅱ期。
五、國內外核心差異:技術、監管與可及性的本質區別
| 對比維度 | 國內 | 國外(以美、歐為典型) |
|---|---|---|
| 技術路徑側重 | 廣泛探索型:以MSCs(改善微環境)為主流,同時在尿液來源細胞等無創再生路徑上有特色突破。 | 縱深突破型:資源高度集中于少數已進入后期臨床的自體細胞再生路徑,追求在明確路徑上取得確證性成果。 |
| 監管環境 | 轉型規范期:從相對寬松向藥品級嚴管過渡,呈現“正規臨床試驗”與“商業探索性治療”并存的局面。 | 成熟嚴管期:遵循全球最嚴格的藥品監管體系(FDA/EMA)。任何臨床應用必須基于獲批的臨床試驗,商業性治療幾乎無法合法開展。 |
| 患者可及性 | 相對容易:信息多,渠道多,接觸各種“治療”機會多。 | 極其困難:對國際患者而言,幾乎只有“參與頂尖機構臨床試驗”一條路,且門檻極高。商業化治療法律風險大、天價。 |
| 核心風險 | 質量與欺詐風險:面臨機構資質、細胞質量、數據真實性和過度承諾的風險。 | 經濟與法律風險:面臨極高費用、可能的法律合規問題,以及無法獲得預期效果的風險。 |
| 核心成本 | 從免費臨床試驗到數十萬人民幣不等的商業項目。 | 參與臨床試驗費用較低,但生活旅宿成本高;非臨床試驗渠道,綜合費用常達百萬至數百萬人民幣級別。 |
六、給您的5條選擇策略與建議
面對干細胞治療慢性腎病的多樣選擇,患者在做決策時應理性評估自身情況、治療目標和可承受的風險與成本。以下是幾個參考策略:
1.評估自身病情與治療需求:明確慢性腎病分期、合并癥情況和腎功能下降速度。判斷自己是希望參與探索性早期療法(可能領先但數據有限),還是傾向等待臨床數據更充分、療效更可靠的成熟療法。
2.關注療法科學依據與臨床數據:了解干細胞來源、作用機制、臨床試驗階段及關鍵療效指標(如 eGFR、蛋白尿、腎纖維化指標等)。優先選擇有公開臨床數據支持、且在正規臨床試驗框架下開展的治療機構。
3.國內選擇建議:可考慮北京、上海、廣州、杭州等一線城市的大型公立醫院或知名干細胞研究中心。這些機構通常技術成熟、研究規范、數據可靠性高,也便于長期隨訪與安全監測。
4.國外選擇建議:如果英語能力良好、經濟條件允許,可以關注美國、日本等國家開展的三期或注冊階段臨床試驗。這些試驗技術相對成熟、數據完整,但就醫成本高,需考慮旅行、住宿及醫保覆蓋問題。
5.綜合決策:治療決策應兼顧科學依據、風險評估、經濟承受能力及個人偏好。與專業腎臟科醫生和臨床研究團隊充分溝通,了解潛在風險、隨訪要求和長期監測方案。
總之,無論選擇國內還是國外,核心原則是正規、數據可查、技術成熟,避免僅憑宣傳或網絡信息做決定。理性評估后再行動,才能讓干細胞治療真正成為延緩病程、改善生活質量的輔助選擇。
結語
干細胞治療正在為慢性腎病患者開辟新的治療途徑和希望。雖然該領域仍處于發展階段,但國內外各有優勢:國內創新活躍、就醫便利,可為患者提供更多探索性選擇;國外技術成熟、臨床數據豐富,為未來療效可靠的再生治療奠定基礎。
通過理性評估科學依據、風險、安全性和個人條件,患者有望將干細胞治療作為延緩病程、改善生活質量的重要手段,為慢性腎病管理帶來積極變化。
參考資料:
[1]https://www.pharnexcloud.com/zixun/zcsp_47779
[2]Xu, Gang; Zeng, Rui; Wang, Kun; Yu, Chong. Safety and Efficacy of Human Umbilical Cord Mesenchymal Stem Cells in the Treatment of Patients with CKD Stages 3-4: A Randomized, Double-Blind, Placebo-Controlled Trial: FR-OR024. Journal of the American Society of Nephrology 36(10S):10.1681/ASN.2025w3nv7730, October 2025. | DOI: 10.1681/ASN.2025w3nv7730
[3]https://investors.prokidney.com/news-releases/news-release-details/prokidney-presents-full-results-phase-2-regen-007-trial
[4]https://sj.jst.go.jp/news/202506/n0627-01p.html?utm_source=chatgpt.com
免責說明:本文僅用于傳播科普知識,分享行業觀點,不構成任何臨床診斷建議!杭吉干細胞所發布的信息不能替代醫生或藥劑師的專業建議。如有版權等疑問,請隨時聯系我。



 掃碼添加官方微信
掃碼添加官方微信