近年來,干細(xì)胞療法在1型糖尿病(T1D)治療中展現(xiàn)出前所未有的潛力,為患者實現(xiàn)“功能性治愈”帶來了新的希望。這種療法通過修復(fù)受損的胰島β細(xì)胞、恢復(fù)體內(nèi)胰島素分泌能力,為長期依賴外源性胰島素的患者提供了全新的治療思路。
作為全球醫(yī)療創(chuàng)新的前沿陣地,美國在干細(xì)胞治療1型糖尿病領(lǐng)域不斷取得突破,不僅推動了相關(guān)技術(shù)從實驗室走向臨床,也為全球研究提供了寶貴經(jīng)驗。
本文將帶領(lǐng)大家回顧美國在干細(xì)胞治療1型糖尿病這一領(lǐng)域的發(fā)展歷程、最新臨床進展,并結(jié)合中美兩國在研究策略和技術(shù)路線上的差異,幫助讀者全面了解干細(xì)胞療法在1型糖尿病中的應(yīng)用前景。
美國干細(xì)胞治療1型糖尿病的臨床轉(zhuǎn)化:25年發(fā)展歷程與技術(shù)突破
一、美國干細(xì)胞治療1型糖尿病25年的發(fā)展歷程
美國在干細(xì)胞治療1型糖尿病的探索始于20世紀(jì)末,其發(fā)展可大致分為四個階段,每一階段都為下一步的突破奠定了基礎(chǔ)。
1.基礎(chǔ)研究階段(2000s–2010s)
在這一階段,美國實驗室率先實現(xiàn)了將胚胎干細(xì)胞(ESC)或誘導(dǎo)多能干細(xì)胞(iPSC)分化為胰島/β細(xì)胞的技術(shù)。這些基礎(chǔ)性研究不僅揭示了β細(xì)胞再生的可行路徑,也為后續(xù)的臨床轉(zhuǎn)化提供了科學(xué)依據(jù)。
2.產(chǎn)業(yè)化與臨床前探索(2010s)
隨著技術(shù)逐漸成熟,產(chǎn)業(yè)化探索開始興起。Semma Therapeutics 開發(fā)出完全分化的干細(xì)胞胰島,并在2019年被 Vertex 收購,將實驗室成果推向臨床化應(yīng)用。同時,ViaCyte 開發(fā)了結(jié)合封裝裝置的干細(xì)胞胰島前體方案,開始在人體中進行臨床驗證。這一階段標(biāo)志著干細(xì)胞療法從理論走向?qū)嵺`的關(guān)鍵轉(zhuǎn)折。
3.早期臨床信號(2018–2024)
在早期臨床試驗中,封裝裝置和自體 iPSC 衍生胰島顯示出積極的治療信號。部分患者餐后 C-肽水平顯著升高,血糖控制得到改善,胰島素需求下降。這些初步成果證明了干細(xì)胞療法在恢復(fù)胰島功能方面的潛力,也為大規(guī)模臨床試驗提供了依據(jù)。
4.里程碑性試驗與產(chǎn)業(yè)化(2024–2025)
近年來,Vertex 的 Zimislecel(VX-880)在 FORWARD-101 試驗中取得突破性進展,多數(shù)患者恢復(fù)自身胰島素分泌,血糖穩(wěn)定,部分患者完全脫離外源胰島素。同時,ViaCyte、Sernova 等公司在封裝器設(shè)計和細(xì)胞功能穩(wěn)定性方面持續(xù)優(yōu)化,為干細(xì)胞療法的廣泛臨床應(yīng)用奠定了堅實基礎(chǔ)。
這一階段標(biāo)志著美國在干細(xì)胞治療1型糖尿病領(lǐng)域已從實驗室研究進入臨床可行性階段,也為全球相關(guān)研究提供了寶貴經(jīng)驗。
二、政策與環(huán)境:美國干細(xì)胞研究的推動力
美國在干細(xì)胞研究與應(yīng)用方面形成了多層次支持體系。
聯(lián)邦層面,F(xiàn)DA 自 2017 年起建立再生醫(yī)學(xué)監(jiān)管框架,對創(chuàng)新療法如 Zimislecel(VX-880)提供快速通道資格,并探索“第三路徑”規(guī)范干細(xì)胞產(chǎn)品標(biāo)準(zhǔn)化與規(guī)模化應(yīng)用。
各州也出臺資金和激勵政策,形成地方支持網(wǎng)絡(luò)。同時,美國重視倫理監(jiān)管與科學(xué)創(chuàng)新平衡,設(shè)立倫理咨詢機制確保研究合規(guī)。
結(jié)合NIH的持續(xù)資金投入和“突破性療法”認(rèn)定,這種政策與資本環(huán)境為干細(xì)胞治療1型糖尿病的快速發(fā)展提供了堅實保障。
也正因為這種政策環(huán)境和資本支持,為美國在干細(xì)胞治療1型糖尿病領(lǐng)域的快速發(fā)展提供了堅實保障。
三、最新臨床進展與技術(shù)突破
Lantidra(donislecel)治療1型糖尿病:FDA第一個批準(zhǔn)的同種異體胰島細(xì)胞療法
2023年6月28日,美國Food and Drug Administration(FDA)正式批準(zhǔn)美國芝加哥生物公司CellTrans, Inc.產(chǎn)品Lantidra用于成人1型糖尿病患者,這也是FDA首個批準(zhǔn)的同種異體胰島細(xì)胞療法。適用于那些盡管已接受強化治療教育,仍反復(fù)出現(xiàn)嚴(yán)重低血糖(SHE)且血糖控制目標(biāo)難以達(dá)成的個體。
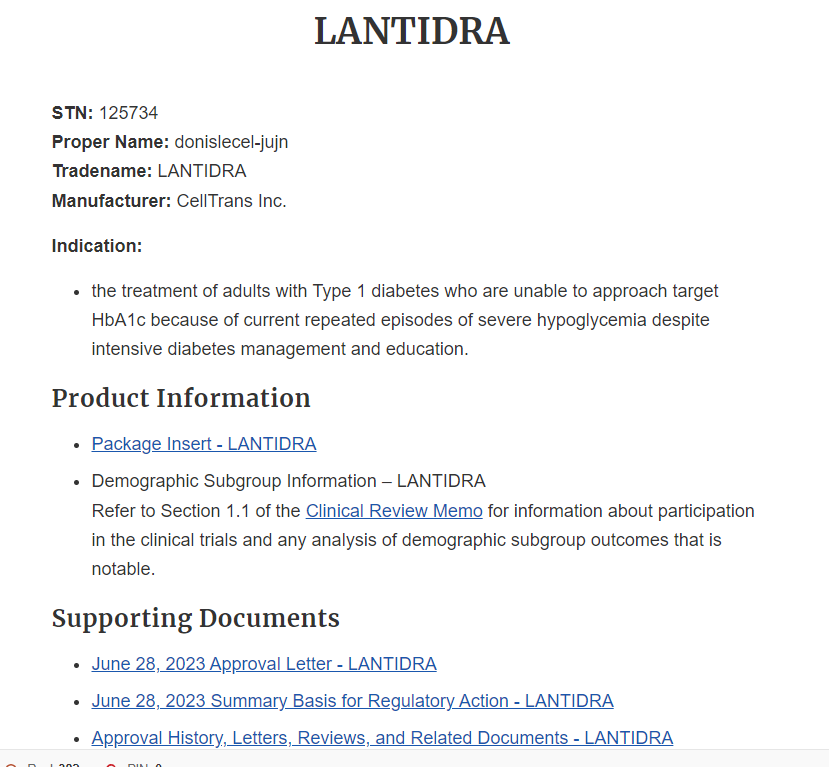
臨床研究基于兩項開放標(biāo)簽單臂試驗(UIH?001 和 UIH?002),共30名患者接受供體胰島移植。其中,21名患者至少一年無需外源性胰島素,10名患者超過五年仍維持獨立使用胰島素。移植物來源于已故供體胰腺,通過肝門靜脈注入,首次劑量為每公斤體重≥5,000相當(dāng)胰島數(shù)量(EIN/kg)。
安全性方面,移植仍存在一定風(fēng)險,包括血管壓力升高、出血、微栓塞,以及免疫抑制相關(guān)的感染或血液異常。因此,嚴(yán)格篩選患者和術(shù)后管理至關(guān)重要。
技術(shù)進展方面,供體胰島細(xì)胞制備和質(zhì)量控制已實現(xiàn)標(biāo)準(zhǔn)化,移植物注入技術(shù)也已制度化。未來研究正探索干細(xì)胞來源的胰島樣細(xì)胞或誘導(dǎo)多能干細(xì)胞(iPSC)分化,以替代供體細(xì)胞,緩解供體資源受限問題。
封裝干細(xì)胞衍生β細(xì)胞:VC?02(PEC?Direct)
在1型糖尿病治療領(lǐng)域,恢復(fù)β細(xì)胞功能一直是科學(xué)家追求的核心目標(biāo)。美國加州圣地亞哥公司ViaCyte Inc. 開發(fā)的VC?02(PEC?Direct)提供了一種創(chuàng)新方案:它將人胚胎干細(xì)胞或誘導(dǎo)多能干細(xì)胞(hPSC)分化為胰島前體(PEC?01),再裝入可血管化、具有免疫隔離功能的封裝器械中植入體內(nèi),為患者體內(nèi)重建胰島功能創(chuàng)造條件。
這一療法的臨床價值在2023年得到了明確驗證。11月27日,比利時布魯塞爾糖尿病研究中心在國際期刊《nature》發(fā)表了題為《封裝的干細(xì)胞衍生β細(xì)胞在1型糖尿病患者中發(fā)揮血糖控制作用》的研究成果。該研究基于 I/II期、多中心開放標(biāo)簽臨床試驗(NCT03163511),通過提高細(xì)胞劑量并優(yōu)化裝置膜穿孔,系統(tǒng)評估了β細(xì)胞功能及血糖控制效果。

1年隨訪顯示,在10例基線C肽不可檢測的患者中,有3例從第6個月起C肽水平達(dá)到≥0.1 nmol/L,并伴隨持續(xù)血糖改善和胰島素劑量下降。
其中表現(xiàn)最好的患者,C肽水平在第12個月達(dá)到0.23 nmol/L,連續(xù)血糖監(jiān)測(CGM)顯示目標(biāo)血糖范圍時間從基線的55%升至85%,胰島素用量明顯減少。其他患者也出現(xiàn)不同程度的血糖穩(wěn)定性提升和低血糖事件減少。
此外,哨兵裝置中的β細(xì)胞存活量在第6個月約為初始量的4%,提示盡管細(xì)胞存活率有限,但仍能產(chǎn)生顯著的臨床信號。整體來看,優(yōu)化后的封裝裝置在提高β細(xì)胞功能和改善血糖控制方面顯示出可觀潛力,為后續(xù)大規(guī)模應(yīng)用和療效優(yōu)化提供了方向。目前暫無最新的臨床進展。
Vertex的VX-880:從1/2期到3期的飛躍
2025年6月,福泰制藥(Vertex)公司在美國糖尿病協(xié)會(ADA)科學(xué)年會上震撼發(fā)布FORWARD-101臨床試驗的1/2/3期的最新研究結(jié)果,并更新了1/2期試驗的最新臨床數(shù)據(jù)。
該研究聚焦于zimislecel(原名VX-880),一種基于干細(xì)胞的完全分化胰島細(xì)胞療法,旨在治療伴有低血糖意識障礙和嚴(yán)重低血糖事件(SHE)的1型糖尿病(T1D)患者。

在FORWARD-101最新臨床試驗中,12名接受單次全劑量Zimislecel輸注的患者接受了至少1年的隨訪,結(jié)果顯示:
所有12名參與者均表現(xiàn)出內(nèi)源性胰島素分泌(通過C肽評估)的恢復(fù),嚴(yán)重低血糖事件的消失,以及血糖控制達(dá)標(biāo)(HbA1c<7%,TIR>70%)。
該療法顯著減少了所有患者的外源胰島素的使用量,平均每位患者都減少了92%,并且在10名患者中完全消除了外源胰島素的使用需求。
與VX-880使用相關(guān)的不良事件與典型的胰島輸注和現(xiàn)有免疫抑制藥物方案一致,未在任何受試者中觀察到額外的不良癥狀。
試驗結(jié)果表明,Zimislecel在1型糖尿病治療中展現(xiàn)出革命性潛力:不僅在1年內(nèi)顯著減少甚至停用外源胰島素(平均減少92%),同時血糖穩(wěn)定、低血糖風(fēng)險消失。10人完全擺脫胰島素注射,安全性良好,不良反應(yīng)與常規(guī)治療相當(dāng)。這一突破為糖尿病患者提供了“擺脫每日注射”的新希望,未來或成為治療的重要選擇。

標(biāo)時間。
目前,該療法已順利完成二期試驗,三期研究預(yù)計將在2026年6月結(jié)束,若進展順利,或?qū)⒂?026年底正式上市。
四、中美不同路徑對比:技術(shù)路線的多元化探索
在全球干細(xì)胞治療糖尿病的研究中,中美兩國展現(xiàn)了不同的技術(shù)特色和發(fā)展路徑:
美國偏向標(biāo)準(zhǔn)化與通用型療法:福泰制藥主要采用人胚胎干細(xì)胞系,目標(biāo)是開發(fā)適合廣大患者的“現(xiàn)成”細(xì)胞產(chǎn)品。Sana公司則專注于基因編輯技術(shù),創(chuàng)建低免疫原性的通用型細(xì)胞。
相比之下,中國側(cè)重個體化治療:例如北京大學(xué)鄧宏魁團隊采用化學(xué)重編程技術(shù),將患者自體脂肪細(xì)胞轉(zhuǎn)化為多能干細(xì)胞,再分化為胰島細(xì)胞。這種自體移植方法避免了免疫排斥問題,但成本更高、周期更長。
在監(jiān)管審批方面,美國FDA建立了更為成熟的干細(xì)胞產(chǎn)品審批流程,而中國則采取“雙備案”制度,審批速度相對較慢。
總體來看,兩國在科研策略、技術(shù)路線和臨床實踐上各有側(cè)重,但最終目標(biāo)一致——恢復(fù)胰島β細(xì)胞功能,實現(xiàn)1型糖尿病患者的功能性康復(fù)。
結(jié)語
美國在干細(xì)胞治療1型糖尿病領(lǐng)域的探索,為全球研究提供了寶貴經(jīng)驗,也為患者帶來了真正可行的康復(fù)方案。從實驗室研究到臨床驗證,干細(xì)胞療法正在把“實驗希望”轉(zhuǎn)化為“臨床現(xiàn)實”,為未來1型糖尿病的功能性治愈開辟了新路徑。
參考資料:
[1]https://www.fda.gov/vaccines-blood-biologics/lantidra?utm_source=chatgpt.com
[2]Keymeulen, B., De Groot, K., Jacobs-Tulleneers-Thevissen, D.?et al.?Encapsulated stem cell–derived β cells exert glucose control in patients with type 1 diabetes.?Nat Biotechnol?42, 1507–1514 (2024). https://doi.org/10.1038/s41587-023-02055-5
[3]https://investors.vrtx.com/news-releases/news-release-details/vertex-presents-positive-data-zimislecel-type-1-diabetes
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信