隨著干細胞技術(shù)的不斷提高,國內(nèi)干細胞新藥研發(fā)逐年增長,由此可見國家對于干細胞技術(shù)的發(fā)展的大力支持,未來干細胞技術(shù)將在更廣泛的疾病上獲得突破。
近年來國家重視細胞治療產(chǎn)業(yè)的廣闊應(yīng)用前景,將其納入生物醫(yī)藥領(lǐng)域重點支持和發(fā)展的方向。國務(wù)院、國家科技部、國家發(fā)改委等均在多個政策文件中明確 支持干細胞藥物發(fā)展,北京、天津、湖南等各省市也出臺了多項利好政策。
2024年我國干細胞新藥研發(fā)新增16項干細胞藥物受理!
2024年我國干細胞新藥研發(fā)進入快車道!截止2024年11月26日,已有107項干細胞藥物臨床試驗申請獲得受理,?其中多款干細胞新藥已進入臨床研究階段?。?
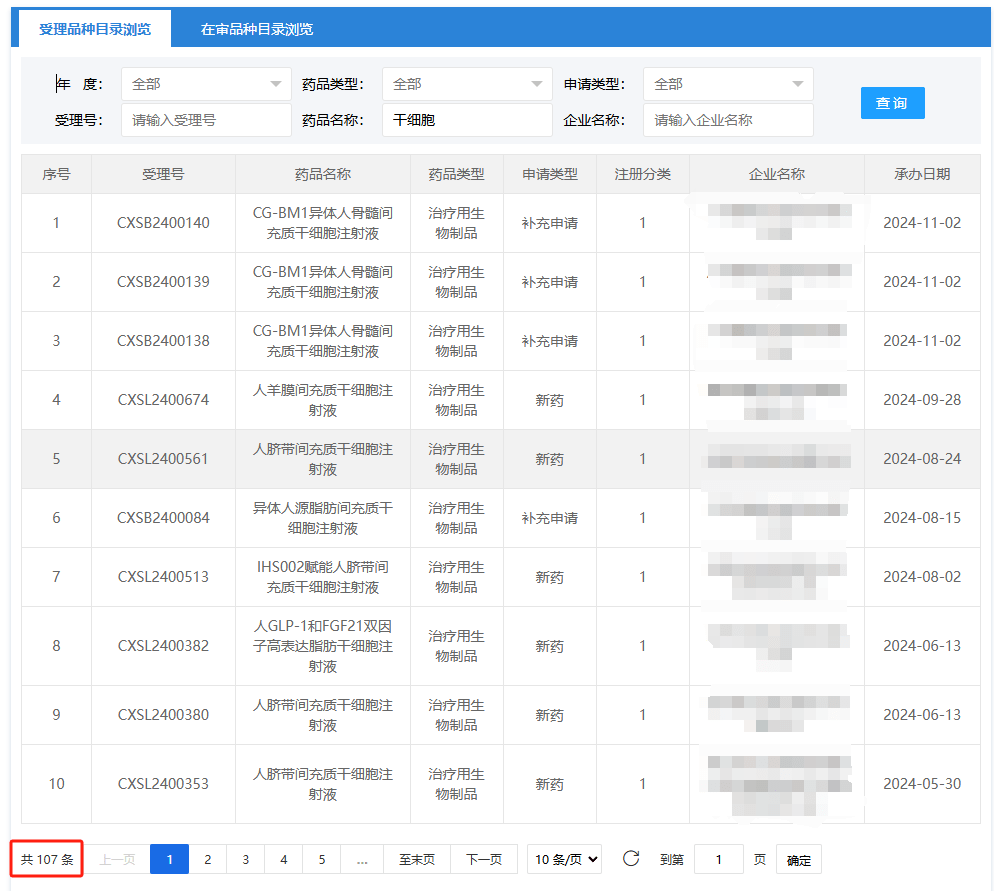
近些年在政策推動下,?我國干細胞產(chǎn)業(yè)迅速擴張,?干細胞新藥研發(fā)速度明顯加快。2024年截止11月26日 ,受理的干細胞新藥達到16項。
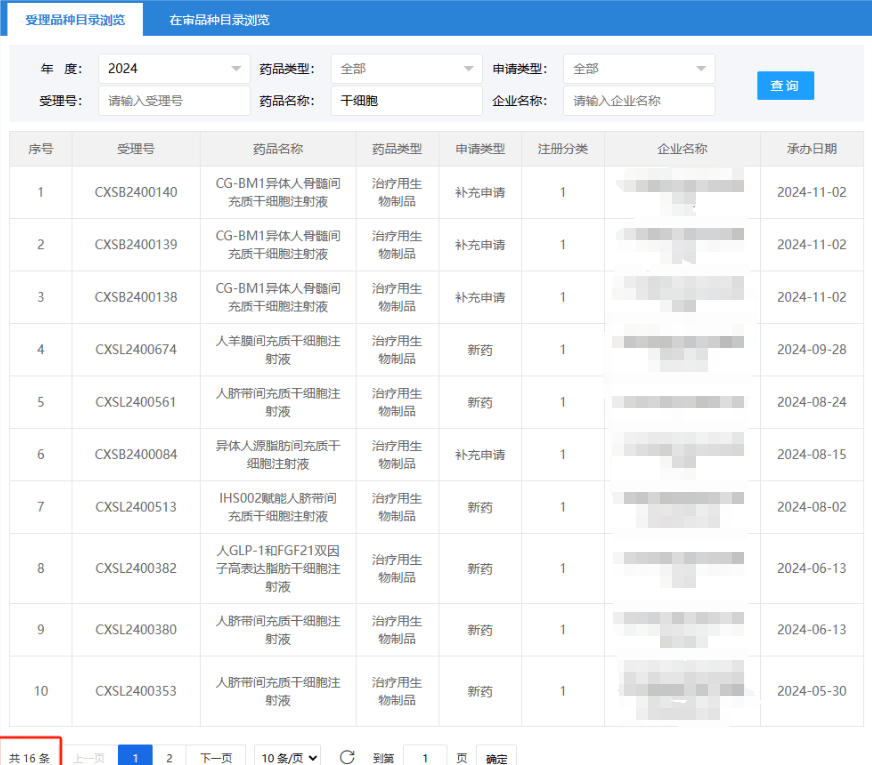
截止2024年11月26日,共有四項干細胞新藥正在受理審批中。
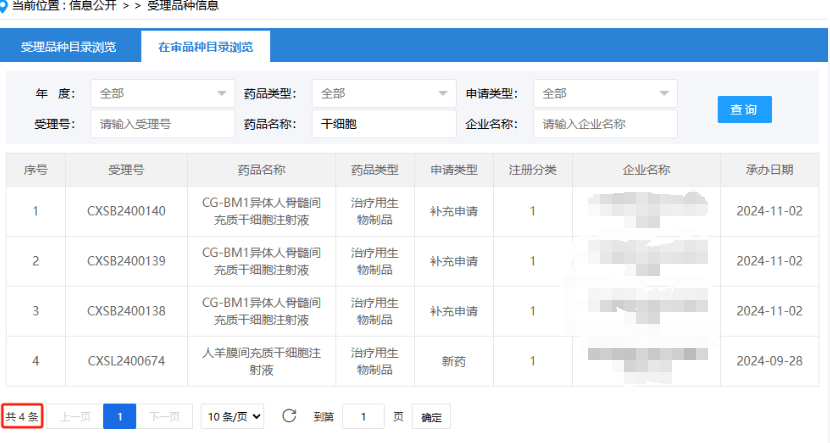
截止2024年11月26日,我國新增受理了哪16項干細胞藥物?
這16項干細胞新藥受理的公司是哪些,受理的干細胞新藥又是哪些?
第一項:2024年1月10日,吉林省拓華生物科技有限公司的(人臍帶間充質(zhì)干細胞注射液);受理號為:CXSL2400023。
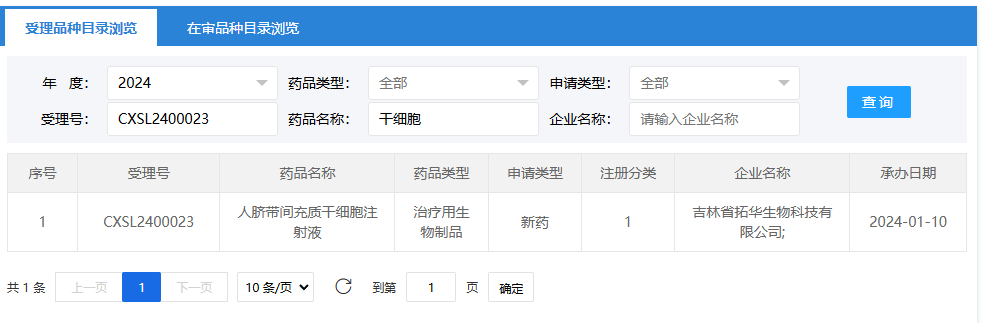
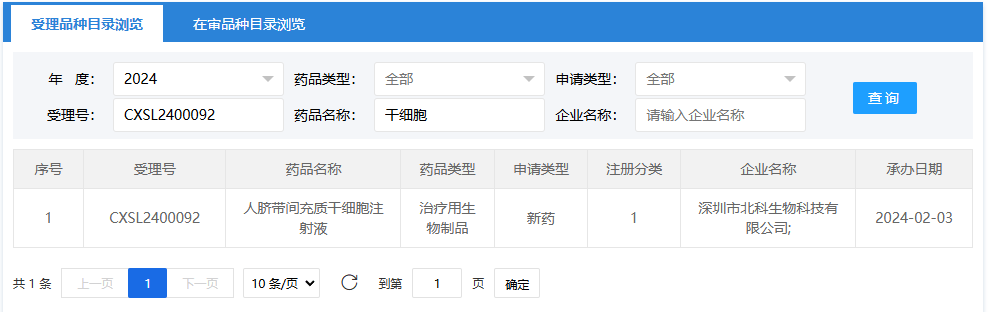
第二項:2024年2月3日,深圳市北科生物科技有限公司的(人臍帶間充質(zhì)干細胞注射液);受理號為:CXSL2400092。
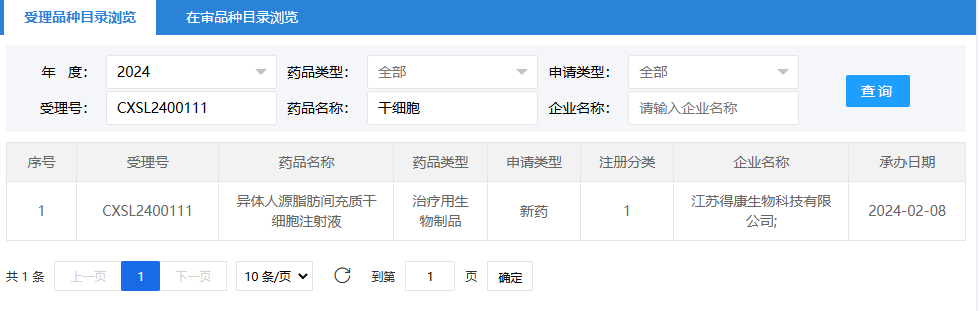
第三項:2024年2月8日,江蘇得康生物科技有限公司(異體人源脂肪間充質(zhì)干細胞注射液);受理號為:CXSL2400111。
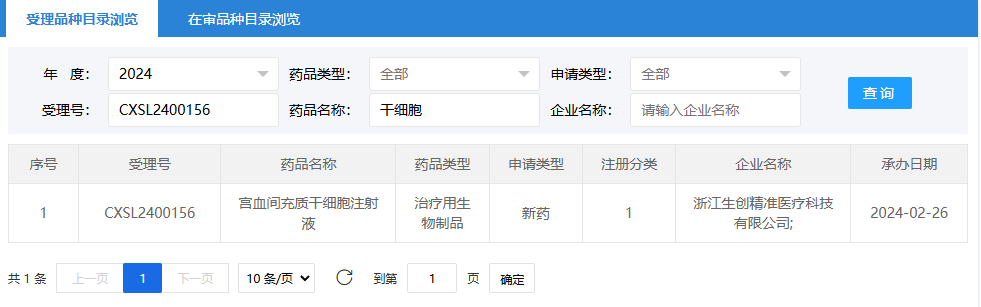
第四項:2024年2月26日,浙江生創(chuàng)精準醫(yī)療科技有限公司(宮血間充質(zhì)干細胞注射液);受理號為:CXSL2400156。
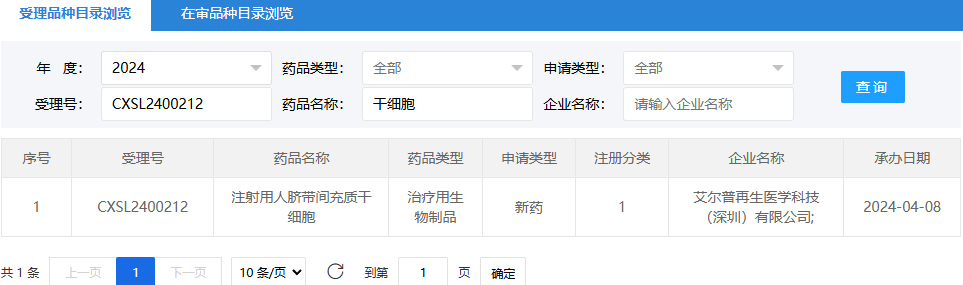
第五項:2024年4月8日,艾爾普再生醫(yī)學科技(深圳)有限公司(注射用人臍帶間充質(zhì)干細胞);受理號為:CXSL2400212。
第六項:2024年4月23日,源品細胞生物科技集團有限公司(人羊膜間充質(zhì)干細胞注射液);受理號為:CXSL2400258。
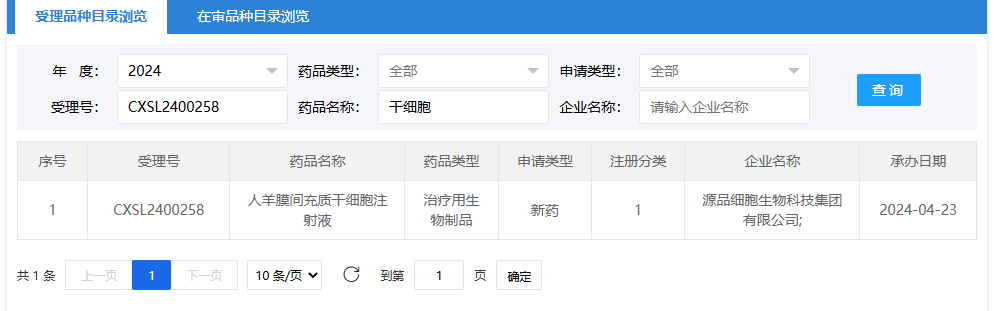
第七項:2024年5月30日,浙江泉生生物科技有限公司聯(lián)合海南新生泉干細胞藥物有限公司(人臍帶間充質(zhì)干細胞注射液);受理號為:CXSL2400353。
第八項:2024年6月13日,杭州易文賽生物技術(shù)有限公司(人臍帶間充質(zhì)干細胞注射液);受理號為:CXSL2400380。

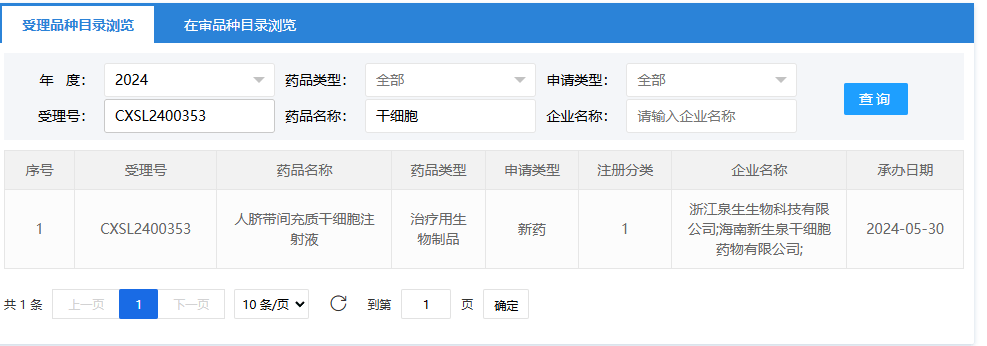
第九項:2024年6月13日,北京吉源生物科技有限公司(人GLP-1和FGF21雙因子高表達脂肪干細胞注射液);受理號為:CXSL2400382。
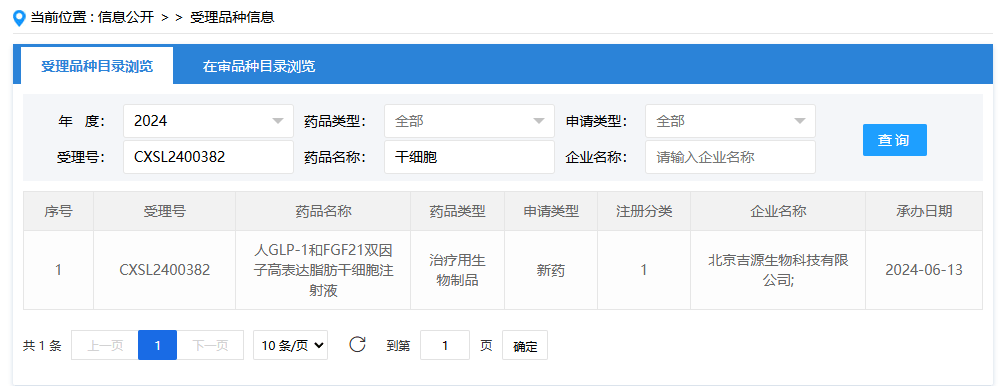
第十項:2024年8月2日,無錫華泰創(chuàng)新藥技術(shù)研究院有限公司(IHS002賦能人臍帶間充質(zhì)干細胞注射液);受理號為:CXSL2400513。
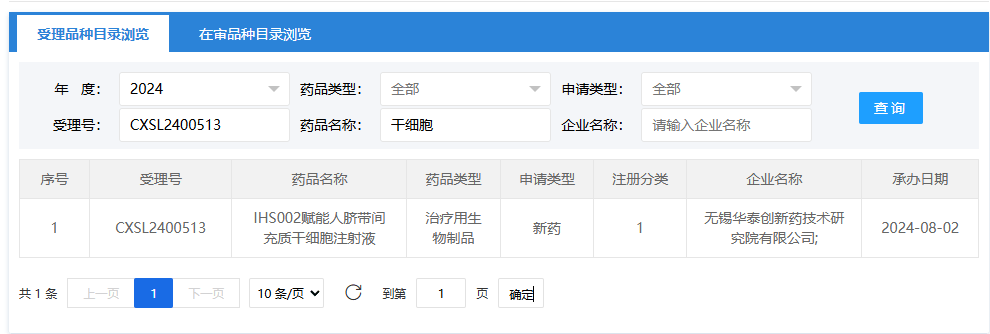
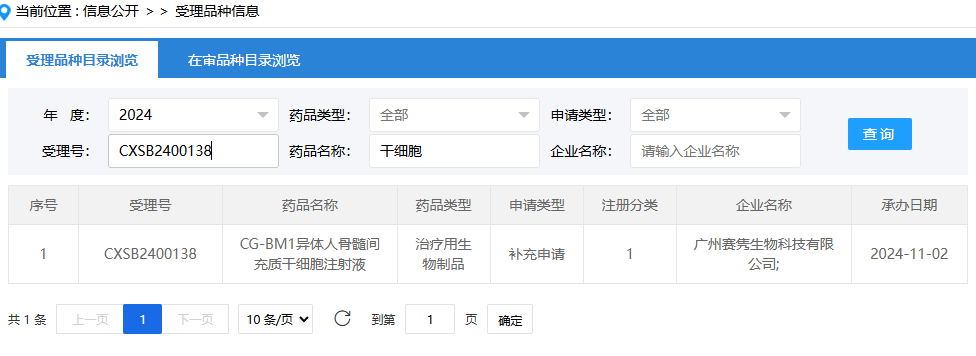
第十一項:2024年8月15日,江蘇得康生物科技有限公司(異體人源脂肪間充質(zhì)干細胞注射液);受理號為:CXSB2400084。
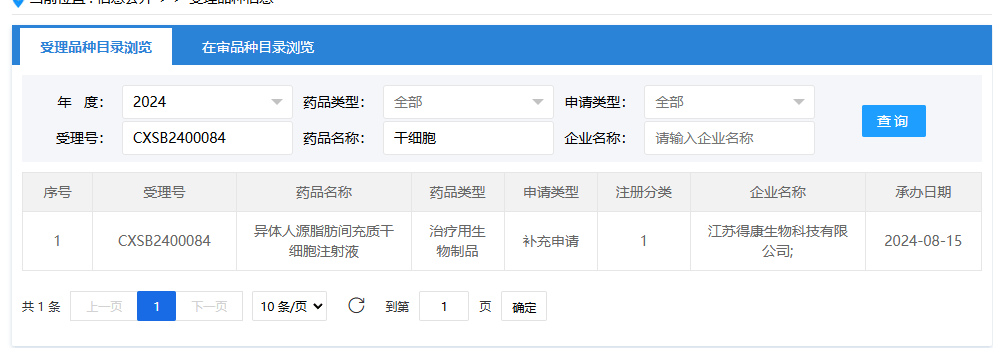
第十二項:2024年8月24日,北京貝來藥業(yè)有限公司(人臍帶間充質(zhì)干細胞注射液);受理號:CXSL2400561。
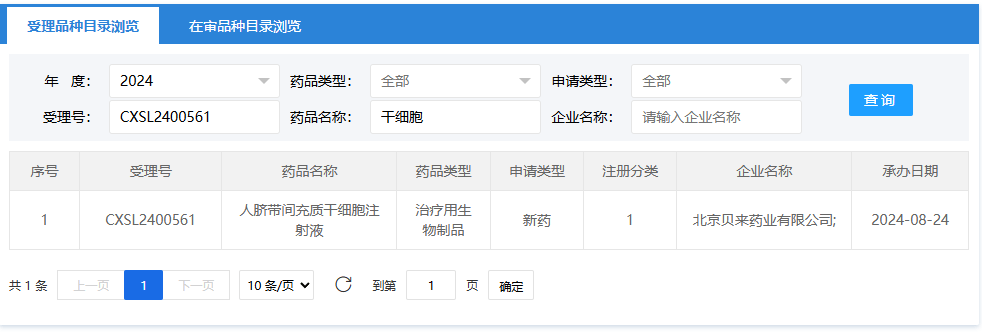
第十三項:2024年9月28日,源品細胞生物科技集團有限公司(人羊膜間充質(zhì)干細胞注射液);受理號:CXSL2400674。
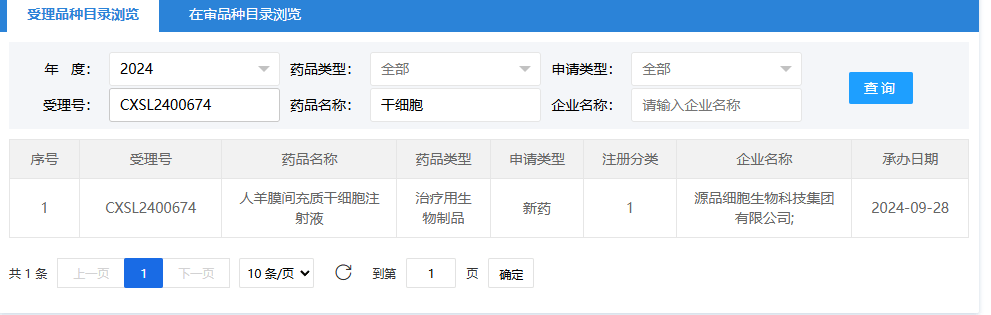
第十四項:2024年11月2日,廣州賽雋生物科技有限公司(CG-BM1異體人骨髓間充質(zhì)干細胞注射液);受理號:CXSB2400138。
第十五項:2024年11月2日,廣州賽雋生物科技有限公司(CG-BM1異體人骨髓間充質(zhì)干細胞注射液);受理號:CXSB2400139。
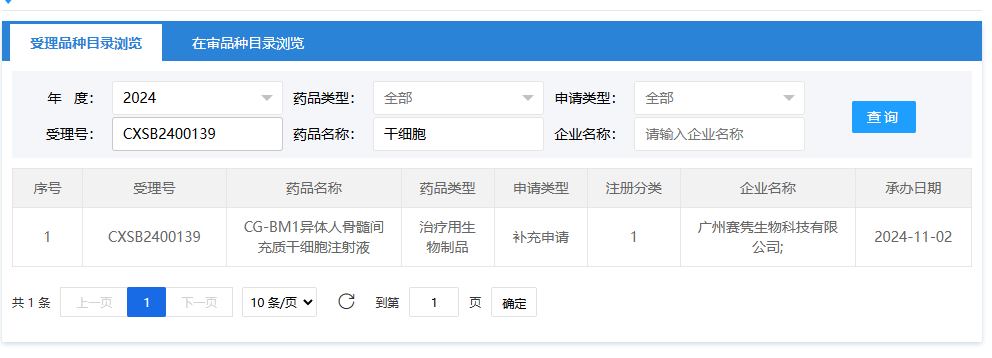
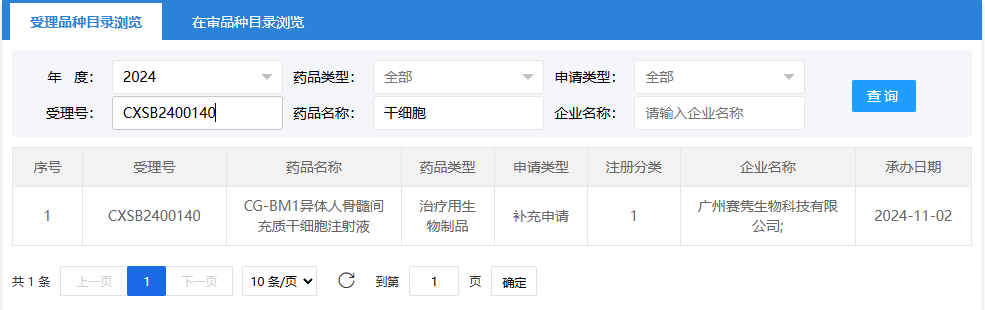
第十六項:2024年11月2日,廣州賽雋生物科技有限公司(CG-BM1異體人骨髓間充質(zhì)干細胞注射液);受理號:CXSB2400140。
國內(nèi)外關(guān)于干細胞治療的臨床研究成果
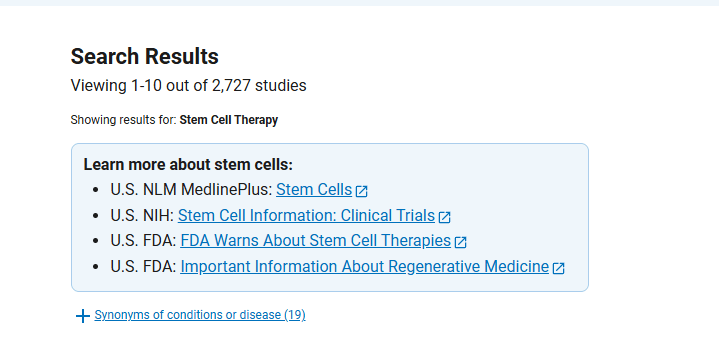
截止2024年11月26日,在美國國立衛(wèi)生研究院的最大臨床試驗注冊庫clinicaltrials.gov網(wǎng)站上注冊的有關(guān)干細胞治療的臨床研究項目有2727項。
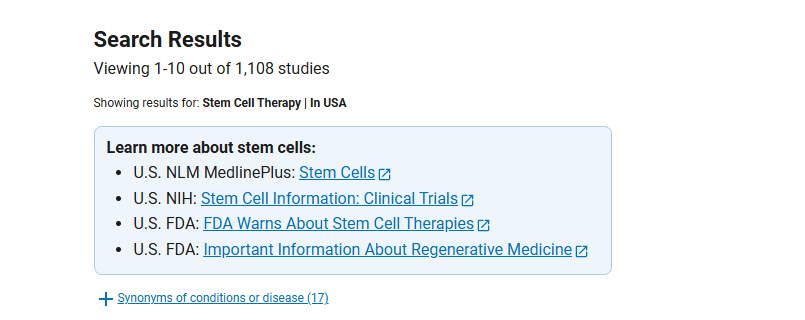
其中在中國進行的干細胞臨床研究的項目有369項,美國進行的干細胞臨床研究的項目有1108項。

全球細胞治療領(lǐng)域在基礎(chǔ)研究領(lǐng)域已取得諸多重大原創(chuàng)性成果。我國干細胞基礎(chǔ)研究位居世界前列,為許多疑難雜癥的治療提供了新的希望。然后由于受到前期市場無序發(fā)展的影響,我國干細胞臨床研究及臨床試驗一度停滯,導致目前干細胞產(chǎn)業(yè)上游存儲業(yè)務(wù)相對成熟,中游開發(fā)和下游應(yīng)用發(fā)展相對滯后的局面。
隨著《干細胞臨床研究管理辦法 ( 試行) 》《干細胞制劑質(zhì)量控制及臨床前研究指導原則( 試行) 》《細胞治療產(chǎn)品研究與評價技術(shù)指導原則(試行)》《基因修飾細胞治療產(chǎn)品非臨床研究技術(shù)指導原則(試行)》《人源干細胞產(chǎn)品藥學研究與評價技術(shù)指導原則(試行)》《人源性干細胞及其衍生細胞治療產(chǎn)品臨床試驗技術(shù)指導原則(試行)》《細胞和基因治療產(chǎn)品臨床相關(guān)溝通交流技術(shù)指導原則》等政策出臺,我國干細胞臨床轉(zhuǎn)化逐步走向正軌,并逐漸明確了以干細胞藥物作為轉(zhuǎn)化出口的道路。
相信2024年度會是干細胞藥物研發(fā)的爆發(fā)期,會有更多針對新適應(yīng)癥的干細胞藥物進入臨床試驗階段。
免責說明:本文僅用于傳播科普知識,分享行業(yè)觀點,不構(gòu)成任何臨床診斷建議!杭吉干細胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。
版權(quán)說明:本文來自杭吉干細胞科技內(nèi)容團隊,歡迎個人轉(zhuǎn)發(fā)至朋友圈,謝絕媒體或機構(gòu)未經(jīng)授權(quán)以任何形式轉(zhuǎn)載至其他平臺,轉(zhuǎn)載授權(quán)請在網(wǎng)站后臺下方留言獲取。



 掃碼添加官方微信
掃碼添加官方微信