《Nature》子刊分析:中國細(xì)胞和基因治療(CGT)的發(fā)展格局與監(jiān)管演進(jìn)
在政府激勵(lì)措施和改革導(dǎo)向的監(jiān)管框架支持下,中國在全球細(xì)胞和基因治療(CGT)領(lǐng)域正發(fā)揮日益重要的作用。國家藥品監(jiān)督管理局(NMPA)通過啟動《藥品監(jiān)管科學(xué)行動計(jì)劃》,強(qiáng)化了對CGT產(chǎn)品的技術(shù)評估研究。與此同時(shí),中國持續(xù)優(yōu)化外商投資環(huán)境,積極鼓勵(lì)該領(lǐng)域的國際合作。
在此背景下,NMPA下屬藥品審評中心(CDE)聯(lián)合清華大學(xué)醫(yī)學(xué)院臨床研究所等機(jī)構(gòu)完成了一項(xiàng)關(guān)于中國CGT發(fā)展格局的全面綜述,該成果已發(fā)表于《Nature》子刊《生物商業(yè)簡報(bào)》。本文基于此項(xiàng)研究,深入剖析中國CGT領(lǐng)域的最新趨勢,包括臨床試驗(yàn)及獲批產(chǎn)品的核心特征(詳見補(bǔ)充信息)。

中國細(xì)胞和基因治療(CGT)領(lǐng)域的趨勢
CGT產(chǎn)品的臨床試驗(yàn)申請(IND)情況
截至2025年第二季度,藥審中心(CDE)共審評了765個(gè)CGT產(chǎn)品的臨床試驗(yàn)申請(IND),其中以CAR-T、干細(xì)胞和基因治療產(chǎn)品為主(見補(bǔ)充圖1)。其中有553個(gè)IND獲批進(jìn)入臨床試驗(yàn)。
未獲批準(zhǔn)的常見原因包括:
- 科學(xué)依據(jù)不足(如作用機(jī)制不明或目標(biāo)人群缺乏已驗(yàn)證的臨床需求);
- 使用非法或不符合倫理的起始材料;
- 藥學(xué)或非臨床數(shù)據(jù)不足以支持臨床試驗(yàn);
- 研究者發(fā)起臨床試驗(yàn)中暴露的安全性問題;
- 聯(lián)合用藥方案偏離已批準(zhǔn)產(chǎn)品標(biāo)簽。
值得關(guān)注的是,上述風(fēng)險(xiǎn)點(diǎn)正逐步改善。補(bǔ)充圖2顯示,IND終止率呈下降趨勢,反映了數(shù)據(jù)質(zhì)量的提升以及CDE技術(shù)指導(dǎo)與臨床前溝通機(jī)制的強(qiáng)化,共同營造了更良性的CGT研發(fā)環(huán)境。
臨床試驗(yàn)格局及在研CGT產(chǎn)品特征
中國CGT產(chǎn)品的臨床試驗(yàn)階段分布見圖1。在各類技術(shù)路徑中,CAR-T產(chǎn)品研發(fā)進(jìn)展最為領(lǐng)先:
- 72項(xiàng)處于探索性試驗(yàn)階段
- 15項(xiàng)進(jìn)入驗(yàn)證性試驗(yàn)
- 7項(xiàng)接受新藥申請(NDA)審評
- 9項(xiàng)已獲批上市(補(bǔ)充表2)
- 另有45項(xiàng)獲批IND尚未啟動試驗(yàn)
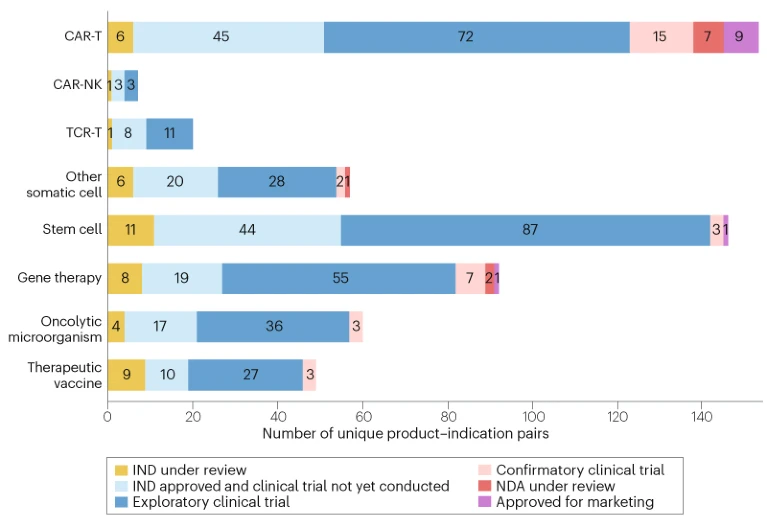
在研細(xì)胞和基因治療產(chǎn)品在不同臨床開發(fā)階段的分布:新藥臨床試驗(yàn)申請 (IND) 正在審評中、IND 已批準(zhǔn)但尚未開展臨床試驗(yàn)、探索性臨床試驗(yàn)、確認(rèn)性臨床試驗(yàn)、新藥上市申請 (NDA) 正在審評并已獲批上市。數(shù)據(jù)按治療類型分類:CAR-T、CAR-NK、TCR-T、其他體細(xì)胞、干細(xì)胞、基因治療、溶瘤微生物和治療性疫苗。
臨床試驗(yàn)活動第二活躍的領(lǐng)域是干細(xì)胞療法,其中44個(gè)IND批準(zhǔn)的產(chǎn)品正在等待啟動臨床試驗(yàn),87個(gè)正在進(jìn)行探索性試驗(yàn),3個(gè)正在進(jìn)行確認(rèn)性試驗(yàn),以及1個(gè)產(chǎn)品(用于治療移植物抗宿主病的“艾米邁托注射液”)已獲批準(zhǔn)。
- 再添10項(xiàng)(2025年6-7月)!中國干細(xì)胞新藥受理突破133項(xiàng),產(chǎn)業(yè)爆發(fā)信號已至!
- 160項(xiàng)臨床許可奠基下,2025年前5月干細(xì)胞新藥受理再加速:12款間充質(zhì)干細(xì)胞產(chǎn)品領(lǐng)跑,造血干細(xì)胞破局
- 2018年-2024年國內(nèi)已審批的干細(xì)胞新藥!!
基因治療領(lǐng)域也相當(dāng)活躍,其中55個(gè)產(chǎn)品正在進(jìn)行探索性試驗(yàn),7個(gè)正在進(jìn)行確認(rèn)性試驗(yàn),2個(gè)正在接受NDA審查,以及1個(gè)產(chǎn)品(用于治療B型血友病的達(dá)納科基因-龐帕沃韋克)近期已獲準(zhǔn)上市。大多數(shù)其他CGT療法仍處于早期開發(fā)階段,但圖1中的數(shù)據(jù)反映了中國CGT的多元化發(fā)展格局。
核心治療類別的適應(yīng)癥分布
進(jìn)一步分析了體細(xì)胞療法(包括CAR-T細(xì)胞療法、CAR-自然殺傷(NK)細(xì)胞療法和T細(xì)胞受體(TCR)T細(xì)胞療法)、干細(xì)胞療法和基因療法三大治療類別的適應(yīng)癥和目標(biāo)(圖2)。
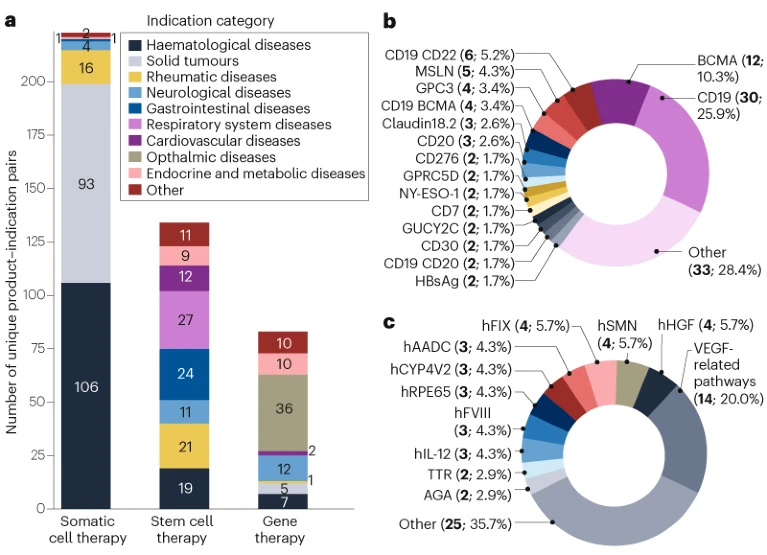
a,適應(yīng)癥分析包括體細(xì)胞治療、干細(xì)胞治療和基因治療。適應(yīng)癥統(tǒng)計(jì)標(biāo)準(zhǔn)與圖1相同。b,體細(xì)胞治療的靶點(diǎn)分析。c,基因治療的靶點(diǎn)分析。靶點(diǎn)統(tǒng)計(jì)以已獲批新藥臨床試驗(yàn)申請的產(chǎn)品數(shù)量為準(zhǔn)。
體細(xì)胞治療
體細(xì)胞療法主要聚焦于癌癥(包括血液腫瘤和實(shí)體瘤)。在B細(xì)胞上表達(dá)的血液腫瘤靶點(diǎn),如CD19和BCMA,是目前最受關(guān)注的方向(見圖2b),并且正在探索多靶點(diǎn)治療策略。
在一項(xiàng)開創(chuàng)性的臨床試驗(yàn)中,研究者發(fā)現(xiàn)針對CD19的CAR-T細(xì)胞療法通過B細(xì)胞清除可使系統(tǒng)性紅斑狼瘡(SLE)患者實(shí)現(xiàn)緩解,這一成果帶來了新的啟示。目前,此類療法也正在被應(yīng)用于探索其他非腫瘤性疾病,如重癥肌無力和系統(tǒng)性硬化癥。
干細(xì)胞治療與基因治療
臨床試驗(yàn)中的干細(xì)胞療法覆蓋的適應(yīng)癥范圍廣泛,不同類型的干細(xì)胞因其特定的功能特性而應(yīng)用于不同疾病。基因療法則主要集中在罕見遺傳病上,包括甲型與乙型血友病、遺傳性視網(wǎng)膜疾病、脊髓性肌萎縮癥以及先天性代謝缺陷。針對VEGF相關(guān)通路的眼病基因療法尤為受關(guān)注,目前已有14個(gè)獲批IND的產(chǎn)品(見圖2c)。
中國已批準(zhǔn)的CGT產(chǎn)品及上市后管理
迄今為止,國家藥監(jiān)局(NMPA)已批準(zhǔn)6個(gè)CAR-T細(xì)胞療法用于9個(gè)適應(yīng)癥(其中7個(gè)為附條件批準(zhǔn),2個(gè)為完全批準(zhǔn)),此外還批準(zhǔn)了1個(gè)附條件批準(zhǔn)的干細(xì)胞療法和1個(gè)完全批準(zhǔn)的基因療法,各對應(yīng)單一適應(yīng)癥(見補(bǔ)充表2)。
在中國獲批的5個(gè)CAR-T細(xì)胞療法產(chǎn)品,均基于單臂臨床試驗(yàn)數(shù)據(jù)。此類試驗(yàn)按照CDE要求,以CAR-T輸注后至少三個(gè)月時(shí)的腫瘤緩解作為主要終點(diǎn),以評估療效持續(xù)性。所有產(chǎn)品均顯示出良好的獲益–風(fēng)險(xiǎn)比,療效明顯優(yōu)于現(xiàn)有治療。
由于研究樣本量有限,上市許可持有人須開展上市后研究,以進(jìn)一步驗(yàn)證療效與安全性。對于附條件批準(zhǔn)的產(chǎn)品,需在批準(zhǔn)之日起規(guī)定期限內(nèi)完成驗(yàn)證性臨床試驗(yàn),最長期限為四年。同時(shí),必須開展長期隨訪及真實(shí)世界研究,對接受CAR-T治療的患者進(jìn)行監(jiān)測。
此外,一款已在海外獲批的CAR-T產(chǎn)品——阿昔卡巴基因西洛侖賽(axicabtagene ciloleucel),通過橋接研究及境外臨床試驗(yàn)在中國完成了評估。橋接試驗(yàn)的主要終點(diǎn)與境外研究保持一致。未來境外研究結(jié)果是否能夠在申報(bào)中被接受,仍需與CDE溝通。
CAR-T上市后風(fēng)險(xiǎn)管理
特別需要強(qiáng)調(diào)的是,在中國,CAR-T細(xì)胞療法的上市后風(fēng)險(xiǎn)管理采取了覆蓋整個(gè)生命周期的綜合策略,以嚴(yán)密保障患者安全和治療有效性,尤其強(qiáng)調(diào)對繼發(fā)惡性腫瘤(如T細(xì)胞淋巴瘤)的監(jiān)測。
盡管國際上已有少數(shù)研究在惡性T細(xì)胞克隆中檢測到CAR轉(zhuǎn)基因,但中國尚未報(bào)告過繼發(fā)性T細(xì)胞淋巴瘤病例。實(shí)際操作中,風(fēng)險(xiǎn)控制措施貫穿研發(fā)和上市全過程:臨床試驗(yàn)文件中強(qiáng)調(diào)需密切監(jiān)測繼發(fā)惡性腫瘤風(fēng)險(xiǎn);產(chǎn)品說明書明確警示相關(guān)風(fēng)險(xiǎn),并要求對患者進(jìn)行終身隨訪;一旦發(fā)現(xiàn)惡性事件,將啟動標(biāo)準(zhǔn)化流程,對治療前后生物樣本進(jìn)行及時(shí)收集和分子分析。
中國CGT的監(jiān)管未來展望
中國的CGT監(jiān)管格局正在迅速演變,以滿足先進(jìn)治療藥物(ATMPs)日益增長的需求。CDE已初步提出了ATMP的分類與描述體系,并正在研究推動其發(fā)展的政策。
展望未來,中國的監(jiān)管模式有望強(qiáng)調(diào)統(tǒng)一部署,同時(shí)遵循“早期介入、一企一策、全程指導(dǎo)、研審聯(lián)動”的原則。CDE或?qū)⒉扇€(gè)案審評模式,根據(jù)不同產(chǎn)品的具體風(fēng)險(xiǎn)、獲益和生產(chǎn)復(fù)雜性,制定差異化策略。隨著CGT領(lǐng)域的快速發(fā)展,中國的監(jiān)管框架也將持續(xù)優(yōu)化,以更好支持創(chuàng)新。
致謝:作者衷心感謝藥品審評中心 (CDE) 的劉曉玲、王華、黃英、趙晨、王建、宋剛、王華和吳曉玲的寶貴貢獻(xiàn)和支持。本研究由藥品監(jiān)管科學(xué)行動計(jì)劃重點(diǎn)項(xiàng)目 (批準(zhǔn)號:RS2024S003) 資助。
參考資料:
[1]:https://nature.o.scidown.top/articles/d41573-025-00126-7
免責(zé)說明:本文僅用于傳播科普知識,分享行業(yè)觀點(diǎn),不構(gòu)成任何臨床診斷建議!杭吉干細(xì)胞所發(fā)布的信息不能替代醫(yī)生或藥劑師的專業(yè)建議。如有版權(quán)等疑問,請隨時(shí)聯(lián)系我。



 掃碼添加官方微信
掃碼添加官方微信